La vida del paciente trasplantado #9: desnutrición y eosinofilia
Paciente de 38 años, enfermedad renal crónica terminal de causa desconocida con hipoplasia renal izquierda.
Trasplante renal de donante cadavérico. Inducción con timoglobulina. Inmunosupresión de mantenimiento: corticoides, micofenolato y tacrolimus. Peso al ingreso: 85 kg.
Antecedentes de obesidad mórbida por lo que se había realizado un by pass gástrico con reconstrucción en Y de Roux un año previo al trasplante.
Se interna al mes post trasplante por fístula urinaria que requirió reimplante ureteral con colocación de sonda vesical, talla vesical y catéter doble jota. Recibió además tratamiento dirigido con meropenem por rescate de Serratia marcescens BLEE. Peso al alta: 69 kg (pérdida de 16 kg, 24% en 1 mes).
Evoluciona con astenia progresiva, disnea a esfuerzos leves, desnutrición y pérdida de peso progresivas. Peso mínimo 62.200 kg. Afebril, con leucocitosis y eosinofilia progresiva (actualmente leucocitos 15960/mm3 → eosinófilos 33% = 5266/mm3; en la internación de la fístula urinaria ya tenía 10% de eosinófilos totales 1030/mm3, dato que había pasado inadvertido).
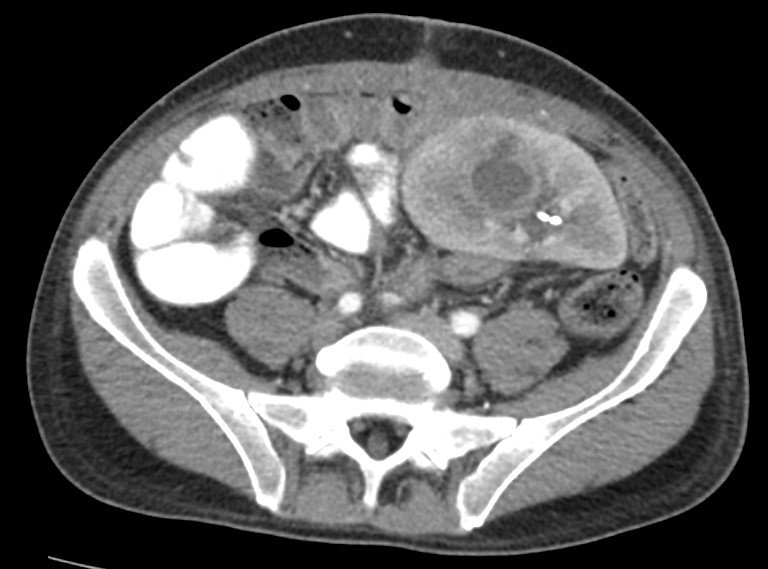
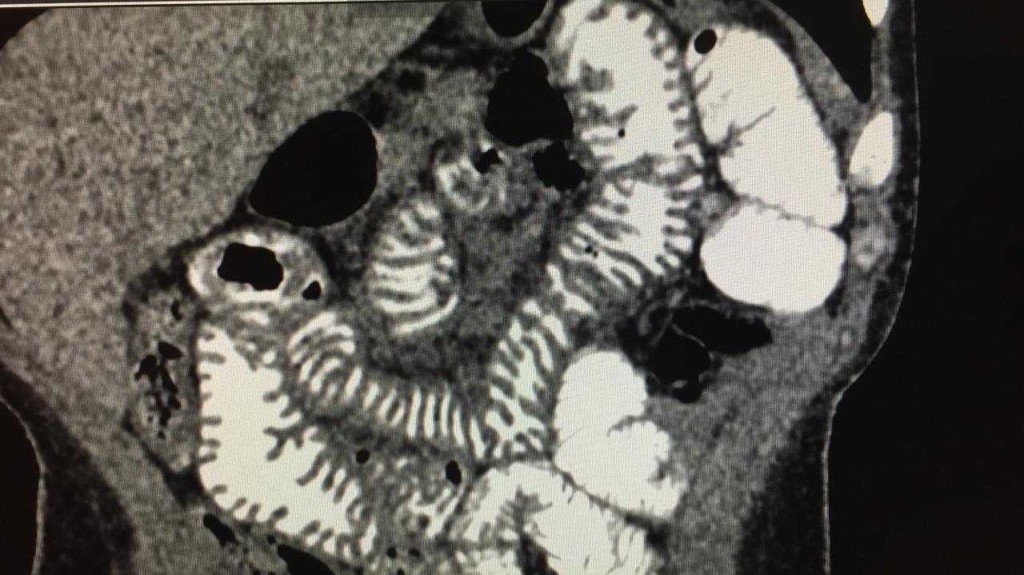
Se interna para estudio. Dada la pérdida de peso rápidamente progresiva se decide iniciar alimentación enteral (SNE en yeyuno) junto a nutrición parenteral total. Evoluciona con dolor epigástrico intenso que dificulta la alimentación. Se solicita tomografía de abdomen y pelvis con contraste oral que muestra evidencias de engrosamiento de intestino delgado (ver imagen).
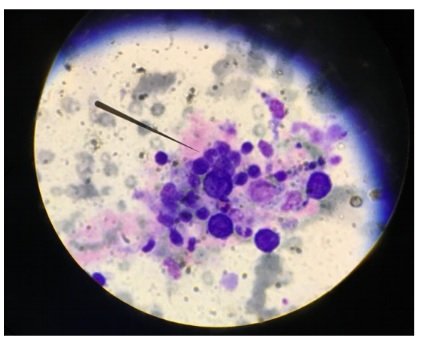
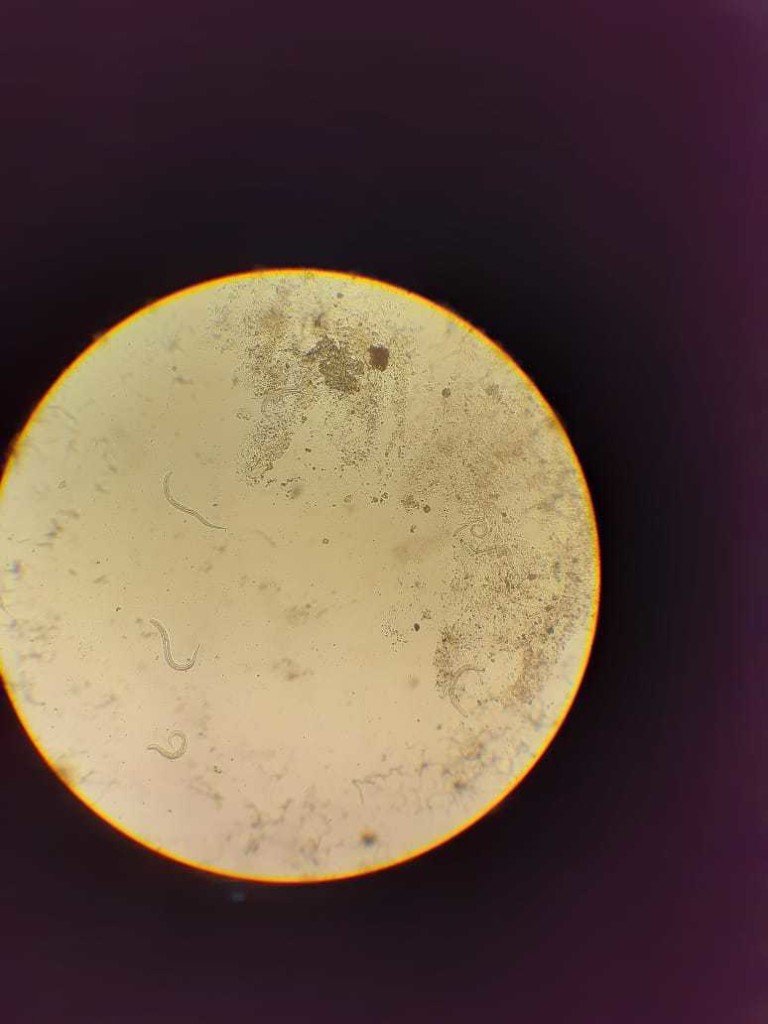
Se solicita frotis de sangre periférica: eosinofilia 29%, impresiona reactiva (ver imagen).

¿Diagnóstico presuntivo?
Se solicitó VEDA que mostró esofagogastroduodenitis leve. Se envió líquido de aspirado duodenal para estudio que confirmó la presencia de Strongyloides stercoralis.
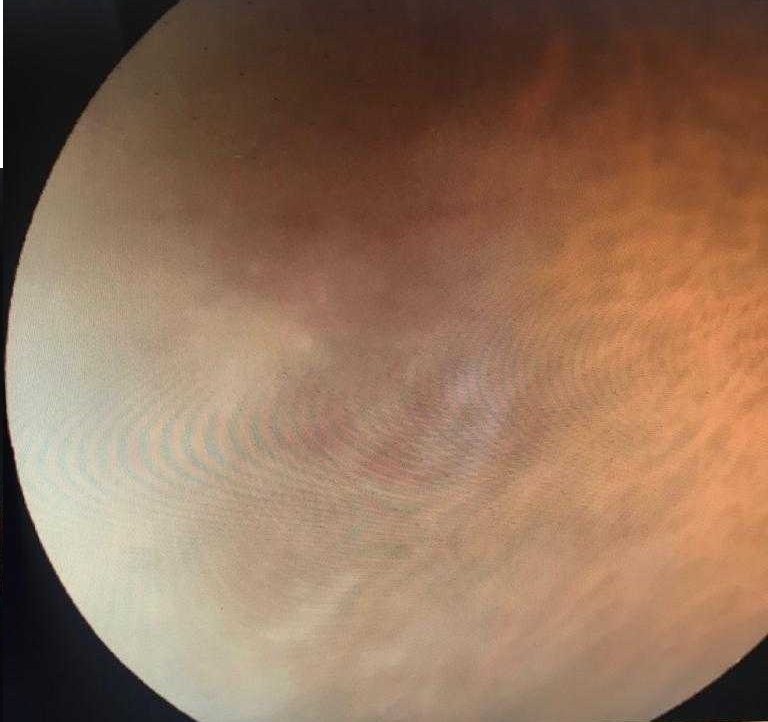
Por persistir con disnea se realizó tomografía de tórax que mostró infiltrados pulmonares, interpretados como parte del síndrome de hiperinfección por Strongyloides (ver imagen).

Inició tratamiento con ivermectina 12 mg por día + albendazol 400 mg cada 12 hs. Presentó tolerancia progresiva de alimentación enteral y vía oral. Mejoría del estado general, recuento calórico adecuado con alimentación enteral nocturna y vía oral diurna. Aumento de peso progresivo y descenso de los valores de eosinófilos (ver imágenes). Parasitológico en día +9 de inicio de tratamiento sin evidencia de larvas en plan de completar 7 días de tratamiento con ivermectina desde el primer parasitológico negativo. Se otorgó el egreso institucional con alimentación por vía oral y suplementos nutricionales.


Reportado por primera vez en 1876 entre soldados franceses en Vietnam con informes de casos fatales iniciales, luego descripto en pacientes inmunocomprometidos en 1996, el Strongyloides stercoralis es un parásito intestinal que tiene un ciclo de vida complejo (ver imagen).

La incidencia real de infección por Strongyloides en pacientes con trasplante de órganos sólidos no está bien definida. Aunque se han documentado casos de infección en receptores de trasplante de hígado, corazón, pulmón, corazón-riñón, intestino y páncreas, los casos se han informado con mayor frecuencia después del trasplante de riñón. Esto puede deberse al hecho de que el trasplante de riñón es una modalidad de trasplante frecuente, a que se han encontrado organismos de S. stercoralis en la orina o que la colocación intraperitoneal del riñón trasplantado hace que el órgano sea especialmente susceptible a la invasión extraintestinal de Strongyloides.
El principal parásito que se debe descartar en presencia de eosinofilia es Strongyloides stercoralis ya que por su particular ciclo biológico puede persistir décadas en el organismo y provocar un síndrome de hiperinfección cuando ocurre una situación de inmunosupresión. En pacientes sin infección por HIV, la principal causa es la inmunosupresión secundaria a corticoides. La infección diseminada se produce por la maduración de larvas filariformes a rabditiformes (forma infectante) en el intestino delgado. Las larvas atraviesan el intestino y se diseminan en forma hematógena llevando consigo flora entérica a otros órganos.
En los pacientes con trasplante de órgano sólido, el síndrome de hiperinfección por Strongyloides se produce principalmente por reactivación de una infección crónica del receptor aunque también puede transmitirse por infección del órgano recibido. Se manifiesta mayormente en los primeros 6 meses post-trasplante. Tiene alta mortalidad y el diagnóstico suele ser tardío. Es fundamental el estudio pre-trasplante con estudio parasitológico seriado. Se relaciona además con infección por HTLV I-II.
Para el diagnóstico, siempre se debe pensar en este parásito ante la presencia de eosinofilia. El estudio de la materia fecal es de elección. Sin embargo, una sola muestra tiene una sensibilidad de solo el 15-30%, pero con el examen de heces seriado en un laboratorio experto, la sensibilidad se acerca al 100%. También se cuenta con serologías y estudio de la materia fecal mediante PCR (pruebas no siempre disponibles en la práctica diaria). Además, como el caso mencionado, puede solicitarse el estudio de material gastroduodenal para establecer el diagnóstico.
En cuanto al tratamiento, la ivermectina se encuentra disponible tanto por vía oral como subcutánea o rectal. La única aprobada en el humano es la vía oral. Esta droga provoca bloqueo muscular y nervioso en el parásito. Se recomienda la administración de 200 mcg/kg por día por dos días (comprimidos de 3 y 6 mg) y repetir en dos semanas (duración del ciclo de autoinfección). El tacrolimus puede aumentar la disponibilidad de ivermectina. En el síndrome de hiperinfección las recomendaciones tienen poca evidencia. Se sugiere mayormente administración diaria por 7-14 días luego de una muestra parasitológica seriada negativa. En presencia de íleo debe considerarse el uso de ivermectina subcutánea (presentación veterinaria). Además, se puede utilizar albendazol, que daña los microtúbulos de las células intestinales de los nematodos. La dosis es 400 mg cada 12 hs vía oral. Puede combinarse con ivermectina en infecciones graves. Su absorción mejora cuando se administra con comidas grasas. Debe realizarse monitoreo de enzimas hepáticas y hemograma por toxicidad.
Algunos autores sugieren seguimiento mínimo de un año con parasitológicos seriados luego del tratamiento. La eosinofilia mejora luego de 3 meses de completado el tratamiento por lo que la persistencia de eosinofilia más de un año puede significar falla en la erradicación del parásito. De hecho, existen trabajon que sugieren que la cura parasitológica es poco probable. La estrongiloidiasis debe considerarse una infección crónica y a administración de ivermectina deben reevaluarse periódicamente.
Para finalizar, se adjunta una tabla que resume las medidas preventivas recomendadas en donantes y receptores de trasplante de órgano sólido:
| Prevención | PreTx / PostTx | Recomendación |
| Primaria | PreTx y PostTx | Adecuada higiene personal Usar calzado al viajar a zonas endémicas Aislar pacientes con infección diseminada |
| Secundaria | PreTx y PostTx | Rastreo y tratamiento en los receptores con infección crónica o donantes vivos |
| Secundaria | PostTx | Tratamiento empírico a los donantes vivos de regiones endémicas Tratamiento masivo en regiones endémicas Retratamiento antes de tratar un rechazo |
| Terciaria | PostTx | Profilaxis continua para aquellos que no pueden eliminar la infección (ej., HTLV-1) |
Bibliografía:
– Hayes, J., & Nellore, A. (2018). Management of Strongyloides in Solid Organ Transplant Recipients. Infectious Disease Clinics of North America, 32(3), 749–763
– Camargo, L. F. A., Kamar, N., Gotuzzo, E., & Wright, A. J. (2018). Schistosomiasis and Strongyloidiasis Recommendations for Solid-Organ Transplant Recipients and Donors. Transplantation, 102, S27–S34
– Repetto, S. A., Ruybal, P., Batalla, E., López, C., Fridman, V., Sierra, M., Radisic, M., Bravo, PM., et al. (2018). Strongyloidiasis Outside Endemic Areas: Long-term Parasitological and Clinical Follow-up After Ivermectin Treatment. Clin Infect Dis, 66 (10), 1558-1565