La vida del paciente trasplantado #13: disfunción de injerto renal
El siguiente caso clínico ha sido adaptado y traducido al español del siguiente sitio web con autorizacion: https://nephsim.com/
Paciente de 37 años con antecedentes de hipertensión arterial y enfermedad renal crónica terminal secundaria a glomeruloesclerosis focal y segmentaria.
Trasplantado renal (donante cadavérico) hace 10 meses. Inducción con timogloblulina. Anticuerpos donante específicos (DSA) no presentes al momento del trasplante. Mismatch CMV: donante IgG +/receptor IgG -. Serología receptor EBV: IgG +Inmunosupresión de mantenimiento: tacrolimus, micofenolato, prednisona. Profilaxis con trimetoprima/sulfametoxazol. Creatinina habitual 1,2 mg/dl. Buena adherencia al tratamiento farmacológico.
Concurre a control clínico ambulatorio sin referir ningún síntoma.
Examen físico: signos vitales normales, Glasgow 15/15, bien perfundido, sin edemas, cicatriz de inguinotomía a nivel de fosa ilíaca derecha sin secreción ni flogosis, bordes afrontados. Injerto renal se palpa no doloroso.
Trae análisis de laboratorio de rutina:
Hto 35,7%, Hb 11,9 g/dl, GB 4800/mm3, Plaquetas 180.000/mm3, 139/4,8/101, Urea 18 mg/dl, Creatinina 1,95 mg/dl, Glucemia 103 mg/dl, Bilirrubina 0,4 mg/dl, GOT/GPT 22/17 U/L, FAL 71 U/L.
Dada la disfunción del injerto renal (Cr 1,95 para habitual de 1,2 mg/dl) se le indica al paciente que se hidrate de forma adecuada y que concurra al día siguiente:
- Se repite laboratorio: Creatinina 2 mg/dl
- Sedimento urinario: pH 6, 10-20 leucocitos/cpo, trazas de proteinuria, sin hematíes, ionograma 30/20/25
- Índice Proteinuria/Creatininuria 150 mg/g
Elija las pruebas de mayor rendimiento diagnóstico (considerando que varias pueden ser de utilidad):
Ecografía de injerto renal
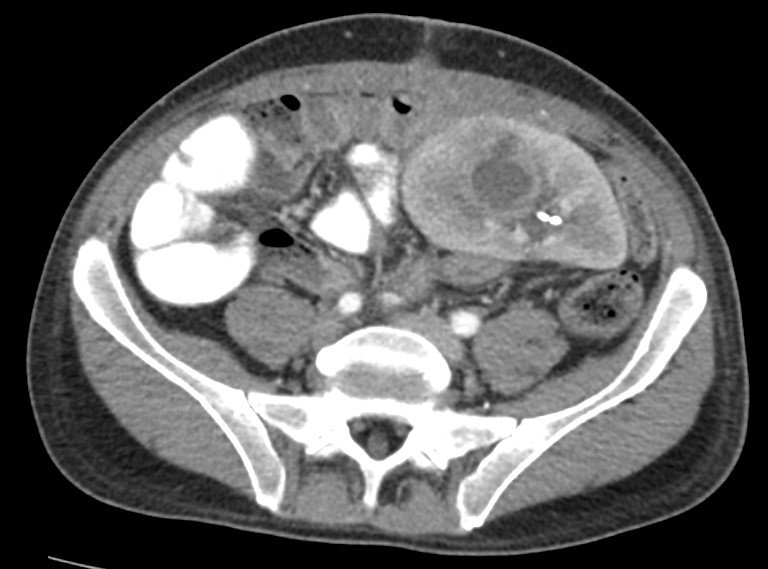
¡Excelente elección! La ecografía es un estudio complementario no invasivo y ampliamente disponible que puede brindar información importante (dilatación pielocalicial, presencia de colecciones periinjerto, medición del índice de resistencia renal mediante el efecto doppler). A continuación, se muestra una imagen obtenida en la ecografía. ¿Qué llama la atención?

Excreción fraccionada de sodio (FENa)
El FENa suele utilizarse como parámetro bioquímico que sustenta el diagnóstico de injuria renal pre-renal (o «hemodinámica«). Sin embargo, las drogas que reciben los pacientes trasplantados renales suelen afectar el transporte tubular de Na+ por lo que el FENa no es un parámetro confiable.
Urocultivo
Las infecciones urinarias +/- pielonefritis del injerto renal pueden ocasionar deterioro agudo de la función del injerto. Sin embargo, en este paciente la tinción de Gram fue negativa y el urocultivo no mostró desarrollo de gérmenes.
PCR CMV en sangre
La combinación de donante IgG+ con receptor IgG- (mismatch) presenta el máximo riesgo para el desarrollo de infección por CMV post trasplante. Paciente con viremia positiva corren riesgo de presentar infección del injerto renal por CMV. Sin embargo, en este caso la PCR para CMV en sangre fue negativa.
Dosajes de valores plasmáticos de tacrolimus
El dosaje de tacrolimus de este paciente es 9.6 ng/ml, en una muestra obtenida a primera hora de la mañana, previamente a que el paciente haya tomado la medicación («en valle»). ¿Cuáles son los efectos adversos del tacrolimus? Click aquí.
Eosinófilos en orina
Si bien su presencia se asocia a nefritis intersticial aguda, este test diagnóstico tiene baja sensibilidad y su valor predictivo positivo para dicha etiología es menor al 40%.
Biopsia de injerto renal
¡Buena elección! La injuria renal aguda en un paciente trasplantado renal debe estudiarse con una biopsia del injerto de no encontrarse ninguna etiología reversible (considerar que la biopsia puede ser un procedimiento invasivo que no está exento de complicaciones).
PCR virus BK en sangre
La viremia por BK es típicamente asintomática y puede ser la causa de injuria renal aguda en pacientes trasplantados. Lamentablemente, los resultados de la PCR demoran en ser informados por el laboratorio.
Anticuerpos donante-específicos (DSA)
¡Muy importante! Investigar el desarrollo de novo de anticuerpos DSA (que se generan luego del trasplante) puede elevar la sospecha de un rechazo mediado por anticuerpos (humoral) como causa de la disfunción del injerto renal. Sin embargo, los resultados no son informados de forma inmediata.
CLICK AQUÍ PARA RESOLUCIÓN DEL CASO
Se decidió realizar biopsia de injerto renal para establecer un diagnóstico definitivo. Se muestra a continuación un corte histológico con poco aumento. ¿Algún dato que sugiera el diagnóstico? (para obtener ayuda con los cortes de patología, click aquí).
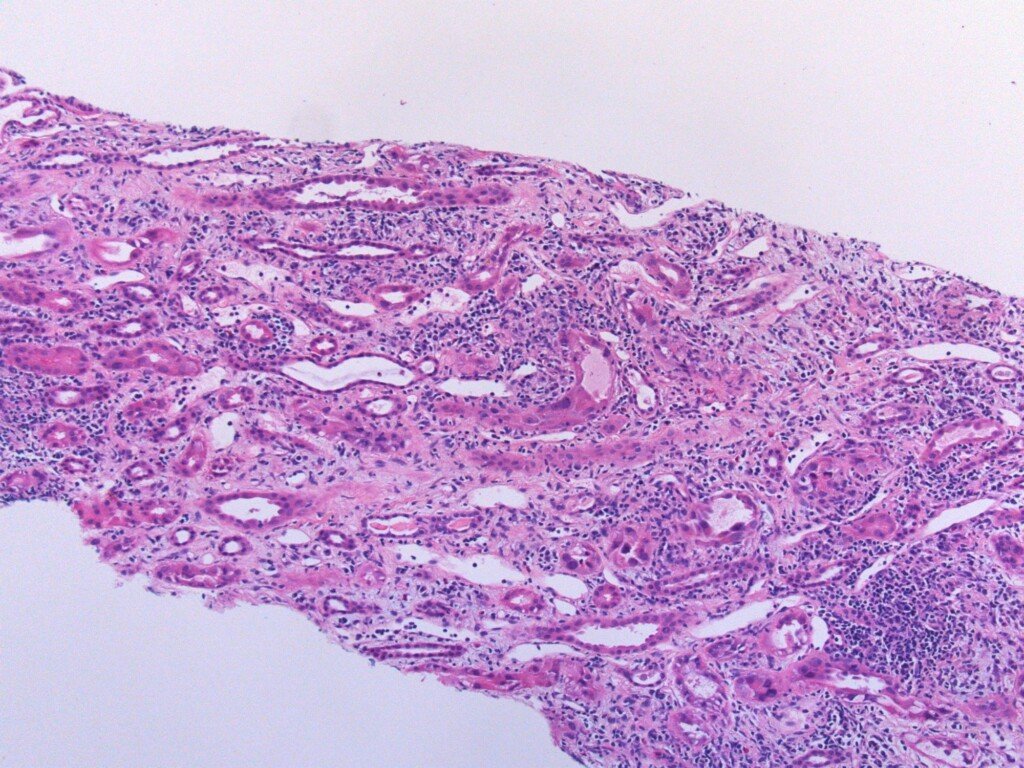
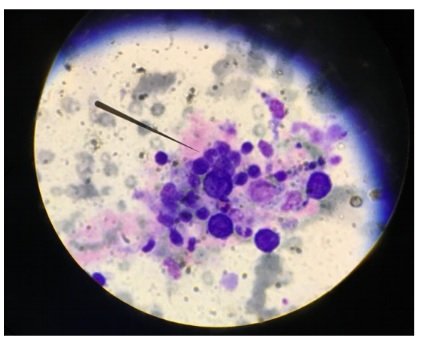
Veamos a continuación un corte histológico a mayor aumento. ¿Qué es lo que marcan los círculos rojos?

La biopsia muestra inclusiones virales basófilas intranucleares las cuales son características de NEFROPATÍA POR VIRUS BK. Este diagnóstico se confirma mediante la tinción de SV40 (simian virus) en técnica de inmunohistoquímica (ver abajo).

Nefropatía por virus BK
El virus BK es un poliomavirus humano altamente prevalente en humanos (60-80%) aunque patógeno en pacientes inmunocomprometidos. La manifestación más común de la enfermedad por el virus BK en pacientes trasplantados renales es la nefritis tubulointersticial. La estenosis ureteral también puede asociarse con la infección por BK que puede sospecharse si existe dilatación pielocalicial en la ecografía (tal como se observava en la imagen ecográfica mostrada más arriba). Además, el BK puede causar cistitis hemorrágica en pacientes con trasplante de médula ósea. Es probable que estas manifestaciones clínicas sean el resultado de la persistencia y replicación del virus en las células epiteliales reno-urinarias.
Son varios los factores de riesgo para Bel desarrollo de la nefropatía por BK el más importante de los cuales es el grado de inmunosupresión. Algunos estudios sugieren un mayor riesgo con el uso de tacrolimus en comparación con ciclosporina aunque se ha observado desarrollo de nefropatía por BK con todos los esquemas de inmunosupresión.
La presentación clínica más común es el aumento asintomático de la creatinina plasmática. El análisis de orina puede ser normal aunque también puede hallarse piuria, hematuria o signos indirectos de nefritis intersticial tales como la aparición de cilindros. La presencia de “células señuelo” (o «decoy cells», llamadas así por su parecido con el carcinoma renal) con sus inclusiones intranucleares basófilas en la citología urinaria pueden proporcionar evidencia de infección por BK, aunque la sensibilidad y la especificidad son bajas. Por otra parte, la viremia por BK, detectada mediante técnica de PCR de ADN viral BK en suero, tiene una mayor sensibilidad y especificidad. Sin embargo, los niveles de ADN viral BK muestran una gran variación entre distintas técnicas y laboratorios por lo que es crucial asegurarse que las muestras a lo largo del tiempo sean obtenidas siempre del mismo laboratorio. También puede detectarse ADN viral en muestra de orina (viruria). Si bien tiene una menor sensibilidad y especificidad en comparación al ADN en suero (viremia), la detección de viruria por BK puede ser la primera evidencia de la infección en el paciente.
Lamentablemente, la presentación clínica que más se asemeja a la nefropatía por BK en pacientes trasplantados renales es el rechazo del injerto. Dado que los tratamientos diametralmente opuestos, es imprescindible realizar una biopsia renal para confirmar el diagnóstico. Los hallazgos histológicos de la nefropatía por BK a menudo incluyen nefritis intersticial y tubulitis, signos que también pueden verse en el rechazo. Es por ello que la presencia de inclusiones virales basófilas intranucleares características (como se ven en la imagen de más arriba rodeadas por círculos rojos), pueden ayudarnos a distinguir estos diagnósticos diferenciales. Es de destacar que tanto el CMV como el virus del herpes simplex también pueden generar inclusiones virales (el CMV más a menudo citoplasmáticas, y el herpes simplex tanto citoplasmátias como intranucleares).
Desde ya, la tinción de SV40 mediante inmunohistoquímica permiten confirmar el diagnóstico. Sin embargo, la tinción de SV40 también puede darse por otros poliomavirus como el JC (aunque la nefropatía por JC es extremadamente rara).
Desafortunadamente, no contamos con un tratamiento antiviral consistentemente efectiva. Entonces, ¿cómo manejamos la nefropatía por BK y cómo evitamos la pérdida de injerto? La mayoría de las instituciones adoptan un enfoque de monitoreo para detectar evidencia de viremia con la detección de PCR de ADN viral BK durante el período inicial posterior al trasplante. Si hay alguna evidencia de disfunción del injerto, se intenta confirmar el diagnóstico mediante la realización de una biopsia renal. Una vez que se confirma el diagnóstico, debe adoptarse una respuesta rápida ya que las tasas de falla del injerto se citan hasta en un 50% en estos pacientes.
Dado que una respuesta inmune efectiva es esencial para el control de la enfermedad, niveles detectables de viremia por BK (con o sin disfunción de injerto) obligar a una reducción en la inmunosupresión (los antimetabolitos, azatioprina o micofenolato, generalmente se suspenden en primera instancia y luego los inhibidores de calcineurina si dicha suspensión no tuvo efecto). Es crucial intentar lograr un equilibrio entre la infección y el rechazo del injerto. Si la disfunción del injerto y la viremia persisten a pesar de la reducción de la inmunosupresión, a menudo se consideran tratamientos adicionales tales como inmunoglobulina intravenosa (IVIG), leflunomida o cidofovir (aunque ninguno ha demostrado un beneficio clínico categórico). Si se produce falla del injerto, el re-trasplante generalmente se difiere hasta que la viremia sea indetectable.
Bibliografía sugerida:
– Danovitch, «Handbook of Kidney Transplantation», 6th Ed.
– Jamboti JS. BK virus nephropathy in renal transplant recipients. Nephrology. 2016;21(8):647-654
– Sharma R, Tzetzo S, Patel S, Zachariah M, Sharma S, Melendy T. BK virus in kidney transplant: Current concepts, recent advances, and future directions. Experimental and Clinical Transplantation. 2016;14(4):377-384.