Para que no te pase #9: brecha de saturación
Este posteo fue posible gracias a una extensa revisión bibliografía realizada por Alexis Marcet y Mayra Mesías
Paciente de 58 años. Trasplantada renal en el año 2016 (donante cadavérico) por glomerulonefritis membrano proliferativa.
Por recidiva de enfermedad de base, a mediados del 2020 recibió tratamiento con ciclofosfamida y rituximab. A los pocos meses, presentó como complicación neumonía bilateral por Pneumocystis jirovecii (PCJ) y reactivación de citomegalovirus (CMV). Recibió tratamiento con trimetoprima/sulfametoxazol (TMS) y foscarnet además de ventilación mecánica prolongada. Egresó a centro de rehabilitación respiratoria donde logró una recuperación exitosa y vuelta al domicilio.
En octubre del 2021 requirió nuevamente ventilación mecánica por una neumonía vinculada a virus sincicial respiratorio. Tras buena evolución clínica, se logró la extubación. Se repuso su inmunosupresión habitual (prednisona, azatioprina y tacrolimus) y se rotó la profilaxis para PCJ de TMS a dapsona por presentar leucopenia. Con el correr de los días, ya no requirió oxigenoterapia.
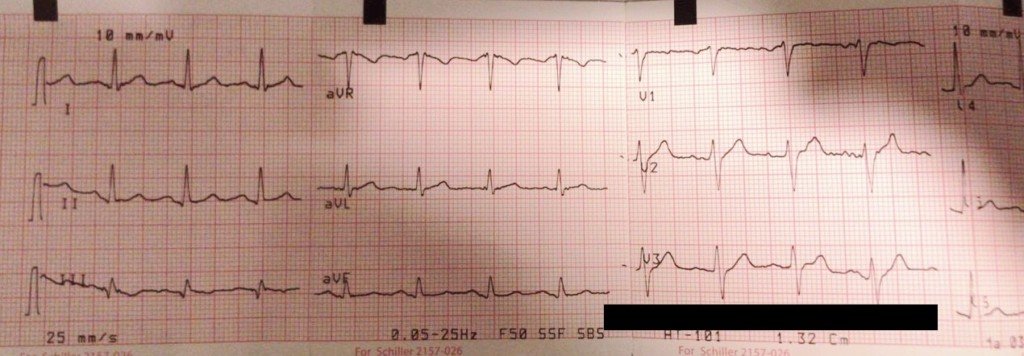
Una noche, el personal de enfermería a cargo solicitó la evaluación por el equipo médico a cargo por presentar desaturación al oxímetro de pulso. Como puede observarse en la imagen, el saturómetro «tenía buena curva» y la frecuencia cardíaca coincidía con la informada por el monitoreo electrocardiográfico:

A pesar del valor informado por el oxímetro de pulso (SatO2 84%), la paciente se encontraba con buena mecánica ventilatoria y no refería disnea. La auscultación revelaba estertores crepitantes en ambas bases pulmonares pero no presentaba otros signos de fallo agudo de bomba.
Se realizó una extracción de gasometría arterial a aire ambiente (FIO2 21%) que arrojó los siguientes valores:

¿Cómo se explica la «brecha de saturación» (SO2 84% por oxímetro de pulso vs SO2 95% por gasometría arterial) en esta paciente?
CLICK PARA VER RESOLUCIÓN DEL CASO
La «brecha de saturación» (o «saturation GAP» en inglés) se describe cuando existe una discrepancia entre los valores de saturación de oxígeno por oxímetro de pulso y los valores de oxihemoglobina. En este caso, el saturation GAP era de 11% = SO2 x gasometría arterial (95%) – SO2 x oxímetro de pulso (84%). Las causas más frecuentes son:
- Desarrollo de metahemoglobinemia
- Intoxicación por cianuro
- Intoxicación por monóxido de carbono
Debido a los cambios de medicación reciente, se sospechó desarrollo de metahemoglobinemia inducida por dapsona.
De la muestra de gasometría arterial informada más arriba, se le solicitó al laboratorio la determinación por Co-oximetría el dosaje de metahemoglobina (MetHb) el cual arrojó un valor del 17%, lo cual permitió confirmar la sospecha clínica.

En individuos sanos, los mecanismos endógenos que nos protegen contra el estrés oxidativo mantienen los niveles de MetHB en menos del 1% de la hemoglobina (Hb) total. Sin embargo, cuando se expone a un agente oxidante o a sus metabolitos, la conversión de Hb en MetHb puede incrementarse más de mil veces y sobrepasar estos mecanismos protectores, causando MetHb clínicamente significativa. La metahemoglobinemia se define entonces como la fracción de MetHb >1% del nivel de Hb de la sangre.
La MetHb se produce cuando la Hb se oxida y se elimina un electrón de uno de los átomos de hierro (Fe) de los grupos hemo. Este cambio en el estado de oxidación convierte el hierro ferroso (Fe++) en el estado férrico (Fe+++). Esto hace que la molécula de Hb sea incapaz de unirse al oxígeno y, además, da como resultado un desplazamiento a la izquierda de la curva de disociación de la hemoglobina. Dependiendo del nivel de MetHb en sangre, la hipoxia tisular puede causar signos y síntomas tales como cianosis, taquicardia, cefalea, disnea, confusión, acidosis, convulsiones, coma y, en última instancia, la muerte.
La dapsona es uno de las tantos medicamentos descriptos (ver aquí, tabla 1) que puede causar MetHb al actuar como una «sustancia oxidante».

¿Cómo se explica la «brecha de saturación»? En pacientes con metahemoglobinemia, la oximetría de pulso informa valores más bajos que las mediciones de oxígeno de los gases en sangre arterial. La oximetría de pulso regular funciona midiendo la absorbancia de la luz en dos longitudes de onda distintas (660 y 940 nm) para calcular la proporción de oxihemoglobina a desoxihemoglobina. La metahemoglobina absorbe luz en ambas longitudes de onda, lo que reduce los valores de la oximetría de pulso. Por el contrario, la saturación de oxígeno de los gases en sangre arterial (oxihemoglobina) se calcula indirectamente a partir de la concentración de oxígeno disuelto en la sangre y no incluye el oxígeno unido a la hemoglobina. Por lo tanto, la saturación de oxígeno arterial medida es a menudo normal en pacientes con metahemoglobinemia, ya que se basa solo en el contenido de oxígeno inspirado y es independiente de la concentración de metahemoglobina. La suplementación con oxígeno puede elevar el nivel de oxihemoglobina, que es una medida de oxígeno disuelto, pero la saturación de oxígeno medida por la oximetría de pulso permanece prácticamente sin cambios («brecha de saturación»). Una diferencia de más del 5% entre la saturación de oxígeno por oximetría de pulso y el análisis de gases en sangre es anormal. Los pacientes con metahemoglobinemia clínicamente significativa suelen tener una brecha de saturación superior al 10%.
En contraste con un oxímetro de pulso tradicional, un CO-oxímetro mide los espectros de absorción de múltiples longitudes de onda de luz diferentes. Los más comunes corresponden a 600 nm (COHb), 631 nm (MetHb), 660 nm (De-O2Hb) y 940 nm (O2Hb).
En cuanto al tratamiento, el primer paso consiste en la suspensión del fármaco causante. Deben instaurarse cuidados de apoyo tales como hidratación, asistencia respiratoria o anticonvulsivantes de ser necesarios. En los casos de metahemoglobinemia tóxica aguda con niveles de MetHb>30% (que es una emergencia médica con complicaciones potencialmente mortales) debe iniciarse tratamiento con azul de metileno.
El azul de metileno, junto con el NADPH, actúa como cofactor de la enzima NADPH MetHb reductasa. Esta reacción contribuye mínimamente a la reducción de la metahemoglobina en condiciones fisiológicas normales. Sin embargo, si se sobrepasan las vías reductoras normales, como en la metahemoglobinemia, esta vía se vuelve muy importante. El azul de metileno actúa aceptando un electrón de NADPH y, en su nueva forma, el azul de leucotileno actúa para reducir el estado férrico (Fe+++) de nuevo al estado ferroso (Fe++) en los glóbulos rojos. Se administra 1 mg/kg de azul de metileno al 1% por vía oral o intravenosa para tratar la MetHb. El azul de metileno se puede volver a administrar si es necesario. Se debe tener precaución con dosis cercanas al nivel tóxico que, paradójicamente, pueden resultar en un empeoramiento de la metahemoglobinemia y hemólisis, especialmente en pacientes con deficiencia de glucosa-6-fosfato deshidrogenasa. Esto se debe a la acumulación de azul de metileno que, en realidad, invierte la reacción de reducción y causa MetHb paradójica.
Bibliografía recomendada:
– When the dissociation curve shifts to the left. Cleve Clin J Med. 2015 Mar;82(3):156-60
– Complications related to dapsone use for Pneumocystis jirovecii pneumonia prophylaxis in solid organ transplant recipients. Am J Transplant. 2005 Nov;5(11):2791-5