La vida del paciente trasplantado #18: hiperglucemia, adenopatía y vasculitis
Paciente de 50 años.
- Enfermedad renal crónica de causa desconocida con requerimientos de hemodiálisis durante 5 años.
- Trasplante renal donante cadavérico hace 4 años. Inmunosupresión: prednisona, micofenolato y tacrolimus.
- Diabetes mellitus post-trasplante. Tratamiento con inhibidores de DPP-4 y correcciones con insulina.
- Obesidad y esteatosis hepática (serologías virales previas negativas).
- Vasculitis urticariante crónica (probable medicamentoso ¿DPP-4? según biopsia de piel previa).
- Internación por politrauma en contexto de accidente automovilístico, con múltiples fracturas y requerimiento de transfusiones.
Por presentar regular control glucémico a pesar de instauración de tratamiento ambulatorio con insulina basal y correcciones se interna para titulación de insulinas. Durante la anamnesis dirigida, refiere adenopatía inguinal izquierda dolorosa que percibió dos semanas antes de la internación.
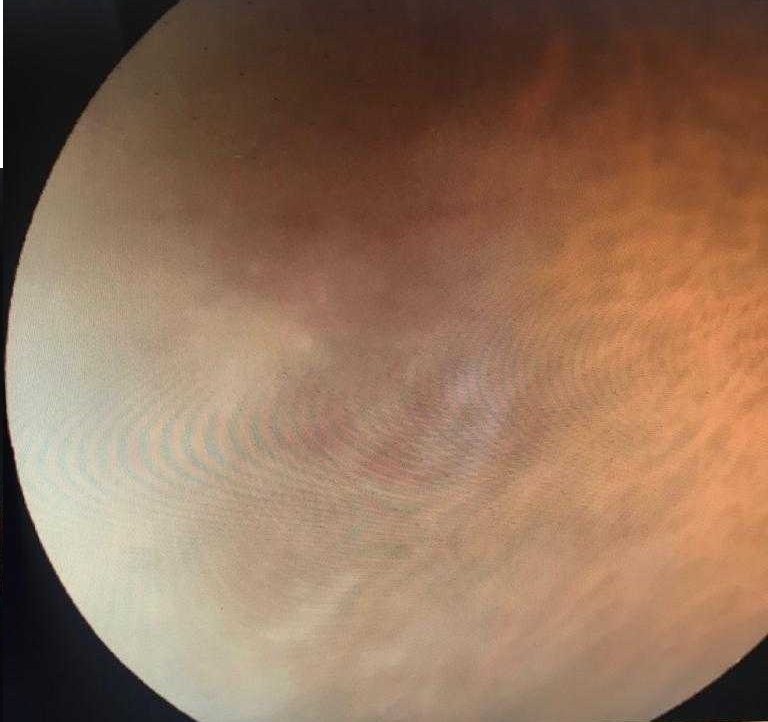
Del examen físico de ingreso, se destaca la presencia de lesiones eritematosas y papulares en región interna proximal de miembros superiores a predominio derecho y en ambos muslos a nivel proximal; las lesiones también se observan en abdomen y dorso con bordes eritematosos y sobreelevados con curación central, pruriginosas. Además, se palpa una adenopatía inguinal izquierda de consistencia duro-elástica, no móvil, dolorosa, de superficie irregular.
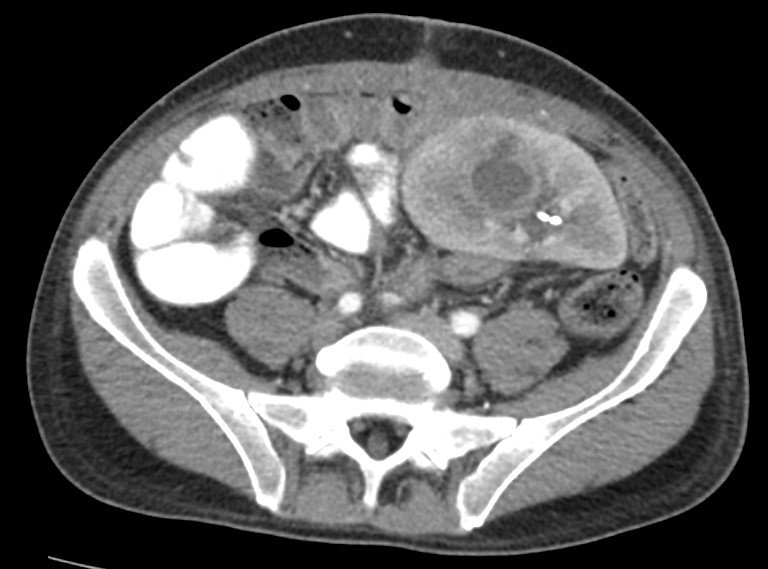
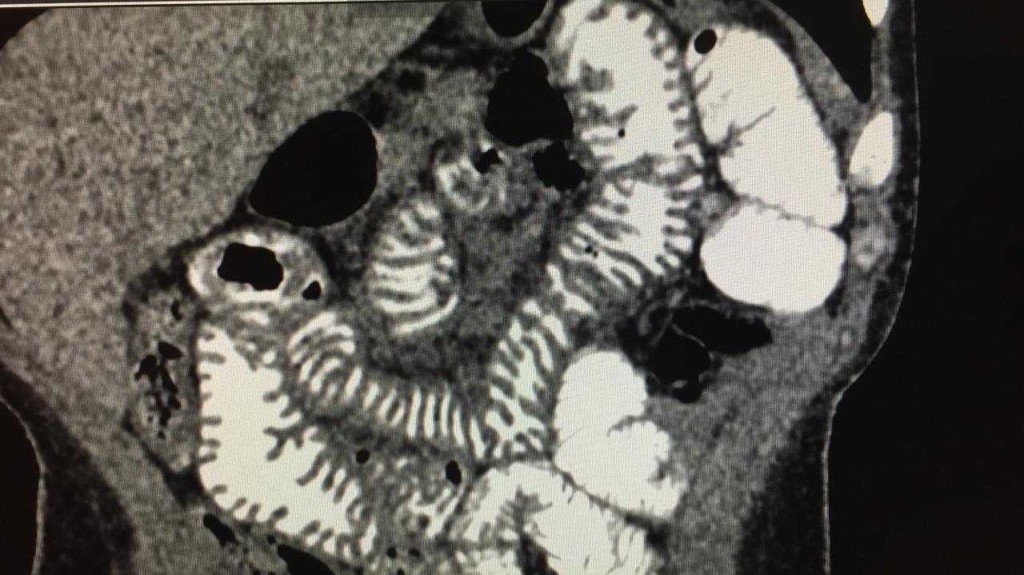
Ecografía doppler de adenopatía inguinal con voluminosa imagen reniforme de 44 x 25 mm con marcada hipoecogenicidad y de bordes irregulares que al examen Doppler color presenta importante vascularización en el hilio de tipo eferente.


Laboratorio de ingreso: Glucemia 384 mg/dl, sin cetonemia ni cetonuria aunque con glucosuria, leucocituria y piuria, creatinia 1,2 mg/dl (habitual), sin leucocitosis, LDH 191 U/L, VSG 45 mm/h, proteína C reactiva 42 mg/L.
Se interpreta hiperglucemia simple en primera instancia, probablemente desencadenada por el desarrollo de E. coli multisensible en urocultivo. Sin embargo, como parte de la evaluación de la adenopatía inguinal se solicitan serologías virales y la realización de una tomografía computada de cuello, tórax, abdomen y pelvis:

Se realiza biopsia excisional de ganglio linfático inguinal izquierdo. Anatomía patológica: proliferación neoplásica constituida por linfocitos en distintos estadios de maduración. Citometría de flujo compatible con linfoma no Hodgkin B. Tinción de Ziehl-Nielsen no detecta BAAR. Sin desarrollo de micobacterias u hongos. Carga viral EBV: 8360 copias/ml.
Se solicitan serologías virales: HBsAg no reactivo, HBc Ac no reactivo, HBs Ac reactivo, HCV Ac reactivo. Se reinterpreta la etiología de las lesiones máculo-papulares halladas al ingreso, planteándose como hipótesis alternativa vasculitis asociada a hepatitis C.
Carga viral EBV: 8360 copias/ml.
La infección por el virus de la hepatitis C sigue siendo muy prevalente en pacientes que se han sometido a un trasplante de órganos sólidos, incluido el trasplante renal. La literatura actual sostiene que existe un marcado aumento del riesgo de diabetes mellitus postrasplante en receptores de trasplante renal positivos para el virus de la hepatitis C. Además, el exceso de riesgo de muerte en los receptores de trasplante renal con virus de la hepatitis C positivo puede atribuirse, al menos parcialmente, a la diabetes mellitus posterior al trasplante con sus complicaciones concomitantes. Además, no son poco comunes las manifestaciones extrahepáticas de la infección por virus de la hepatitis C siendo el compromiso cutáneo el más frecuente (como en el caso descripto).
Concomitantemente, este paciente prestaba diagnóstico enfermedad linfoproliferativa postrasplante (o PTLD, del inglés Post-Transplantation Lymphoproliferative Disease). La incidencia reportada de PTLD en receptores de trasplante de órgano sólido oscila entre 0.8% y 15% dependiendo del tipo de trasplante, de la edad del paciente y del esquema inmunosupresor elegido. La incidencia de síndrome linfoproliferativo en población trasplantada es aproximadamente 12 veces mayor que en población no trasplantada. La incidencia suele ser bimodal, con la mayoría de los casos reportados dentro del primer año post-trasplante y luego del 4to año. Además, en trasplantados renales, la mayoría de los casos de PTLD son linfomas no Hodgkin y están estrechamente relacionados con infección por el virus de Epstein-Barr (VEB), todas características que presentaba el paciente del caso descrito.
Bibliografía:
- Fabrizi, F.; Messa, P.; Martin, P.; Takkouche, B. (2008). Hepatitis C Virus Infection and Post-Transplant Diabetes Mellitus among Renal Transplant Patients: A Meta-Analysis. The International Journal of Artificial Organs, 31(8), 675–682
- Alfredo Rebora (2010). Skin diseases associated with hepatitis C virus: Facts and controversies. , 28(5), 0–496
- Extrahepatic Manifestations Associated with Hepatitis C Virus Infection: A Prospective Multicenter Study of 321 Patients. Medicine, 79(1), 47–56
- Danovitch, Handbook of Kidney Transplantation, Sixth Edición (2017)